各国药典和FDA 数据库收载了部分药物的详细信息,包括药物成分、药物相互作用、剂量指南、药物安全性和有效性等方面的数据。这些信息对于药品研发和注册人员来说至关重要。
研发人员可以查询药物标准、药物分析方法和质量要求,以确保开发的药物符合相关标准和规定。这有助于加快药物研发过程并确保研制出高质量的药物产品。
注册人员可以利用这些查询工具获取药物的相关资料和证据,以支持药品注册申请和审批流程。这包括提供药物的质量数据、临床试验结果、不良反应报告等信息,以评估药物的安全性、疗效和有效性。
1.美国标准查询
1888年,美国药学会出版了第一部国家处方集,名称叫非法定制剂的国家处方集,简称NF。USP和NF是被1906年美国食品药品法和1938年的食品药品和化妆品法所认可的。1975年USP与NF合并出版,叫USP-NF。
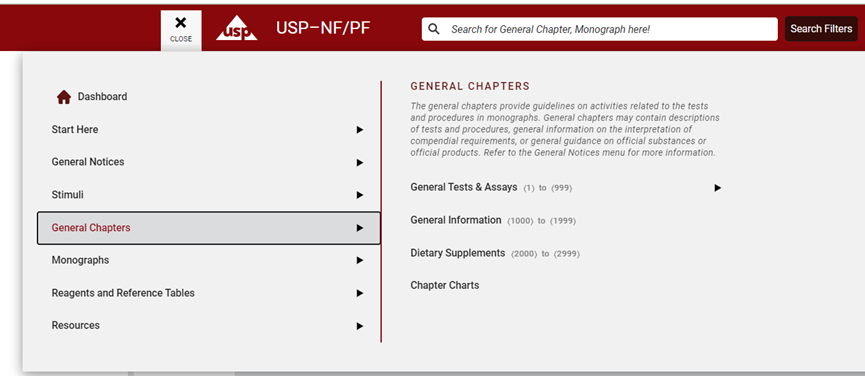
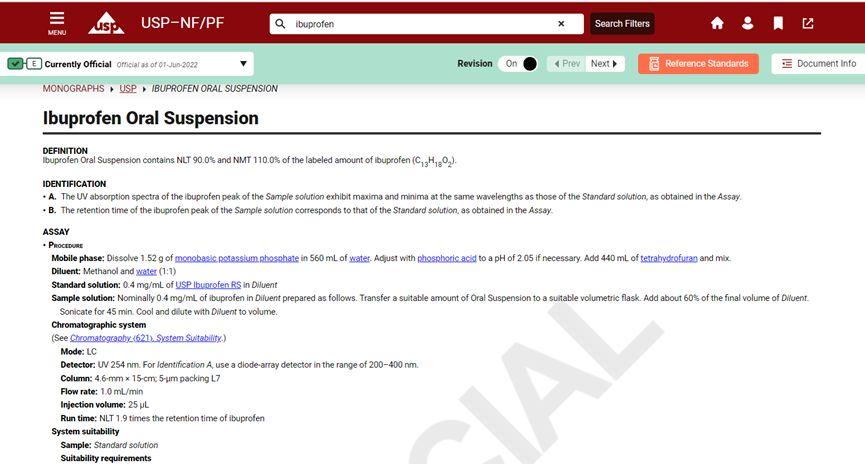
USP–NF收载了药物、生物制品、食品增补剂和赋形剂的科学标准,可用于生产各种剂型和产品。在USP-NP的各论中,一个产品(原料,DS)或制品(制剂,DP)包含其定义、包装、储存、检测项(性状、鉴别、杂质、含量测定)以及判定标准。
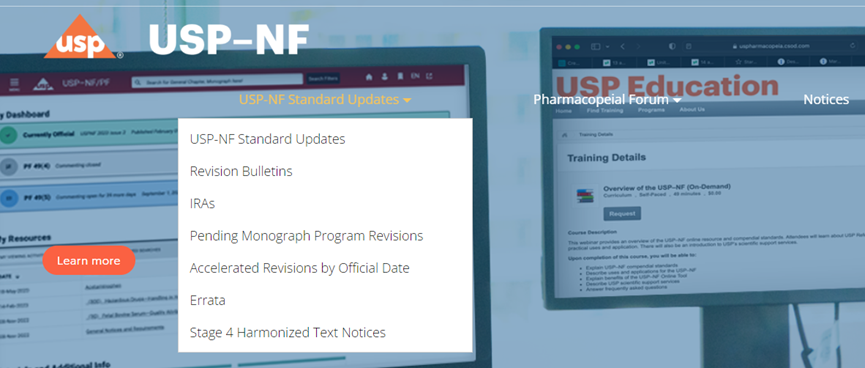
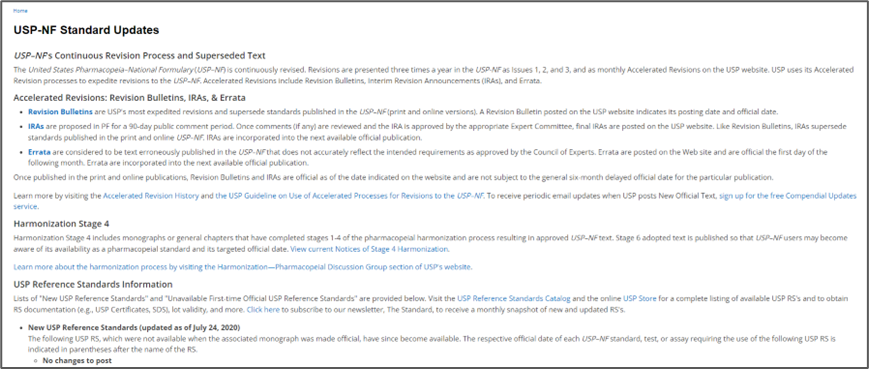
其中包含标准更新(USP-NF Standard Updates),修订公告(Revision Bulletins),临时修订声明(Interim Revision Announcements, IRAs),待审各论”(Pending Monographs),加速修订官方日期(Accelerated Revisions by Official Date),勘误表(Errata)等。
标准更新(USP-NF Standard Updates)
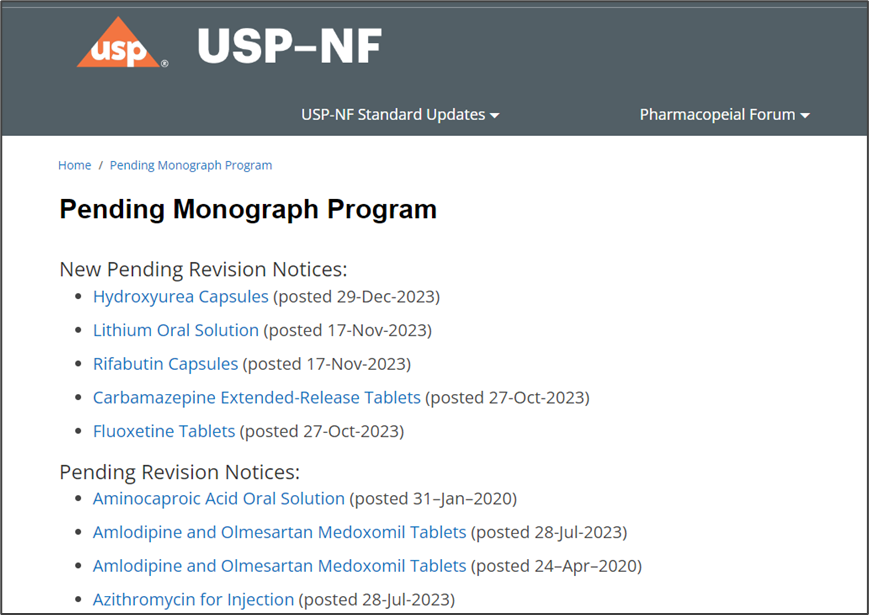
n待审各论(Pending Monographs)
其中的各论品种均为已向FDA提交审请资料或拟提交资料的品种,但均还未取得FDA的上市批准。一旦获得FDA批准,FDA将与申请人一同推进该各论成为正式标准。新增或修订的待审各论每月更新一次,均在每月最后的一个周五。(“Received as Pending”该各论,还未升级为征求意见稿公布在USP网站;“Posted as Pending”已发布在USP的待审各论上,且可获得该各论全文)。
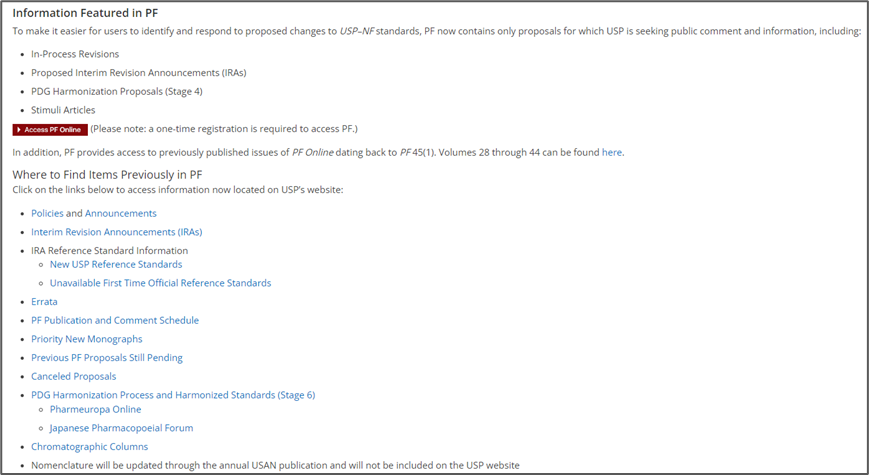
1.2美国药典论坛(Pharmacopeial Forum, PF)
内容有四个部分:正在进行的修订,拟议的临时修订声明(IRA),PDG 协调提案(阶段 4),热点文章。
2.欧盟标准查询(需要付费注册账户,如需可联系作者)
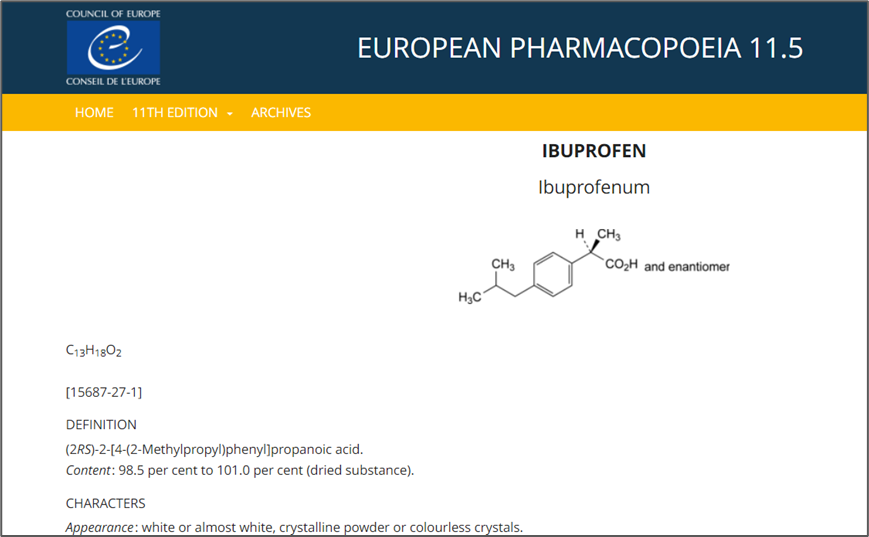
欧洲药典Pharmeuropa(https://pheur.edqm.eu/home。目前已经更新到11.5版。
账户登录后选择药典版本后,可以通过检索药品名称的方式查询(以布洛芬示例)。
3.日本标准查询
进入网站后可以直接搜索“日本薬局方”,即可进入以下页面,目前更新到18版。
日本PMDA药品数据库包含目前在日本批准上市的处方药(RX)、治疗性生物制品,不包含非处方药和汉方信息。主要用途有:1、查询处方药在日本的上市情况;2、寻找一个创新药的仿制药品;3、查看药品的说明书信息;4、查看药品的IF文件(综述资料)。
进入主页后,点击Publications,查找最新的质量标准,但药典原文下载要另外收费。
4.国际药典
有国际卫生组织WHO负责协调和更新,进入主页后,点击search,进入药典的搜索界面,输入关键词就可以搜索相关信息。当前的版本是国际药典2022年第11版。
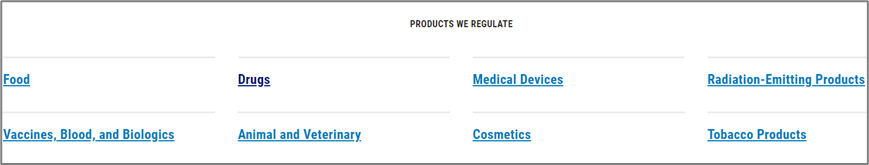
5.美国FDA药品数据库
FDA监管以上8类药食品,关于药品的数据库主要用途有以下几点:
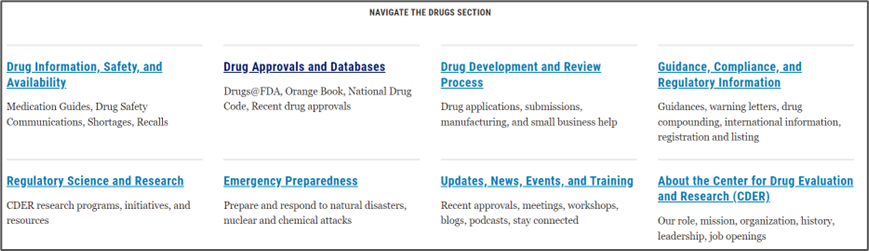
Drugs(药品)专栏是制药工作者最常用的资源,以下内容重点介绍此专栏内容。点击Drugs出现以下界面:
Drugs项下共8个模块内容:药物警戒、召回等安全性信息;药品批准情况和数据库;药品申报和审评流程;指南、合规性和监管信息;科学与研究工具、数据库等;应急准备,以应对自然灾害、恐怖组织等突状况;新的审评进展、新产品和新培训课程等(可下载);关于药品审评和研究中心的介绍,如职责、组织架构。
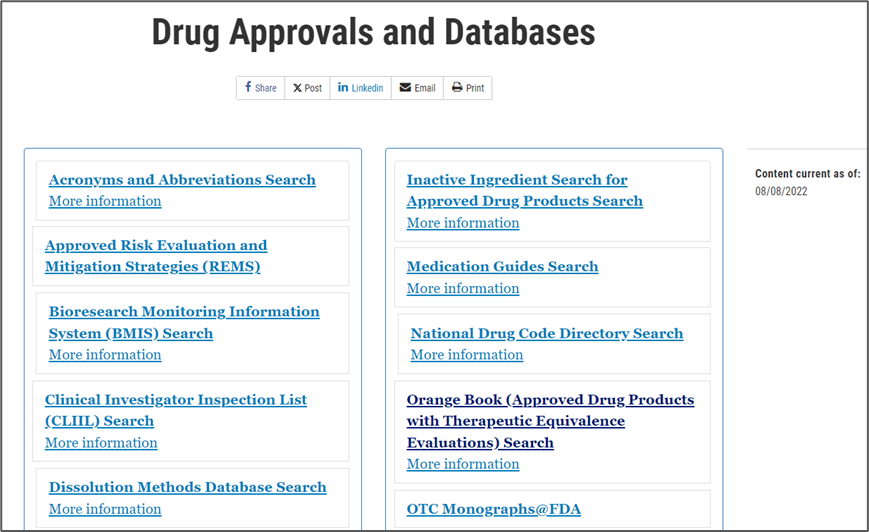
5.1.1. 药品批准情况和数据库(Drug Approvals and Databases)–药品研发常用
包括药品开发、临床研究、风险评估、药品注册与审评、药品信息数据库等资源,内容较丰富、全面,为广大药品工作者提供了诸多参考。
(1) Clinical Investigator Inspection List (CLIIL) Search:可查询临床研究的数据;
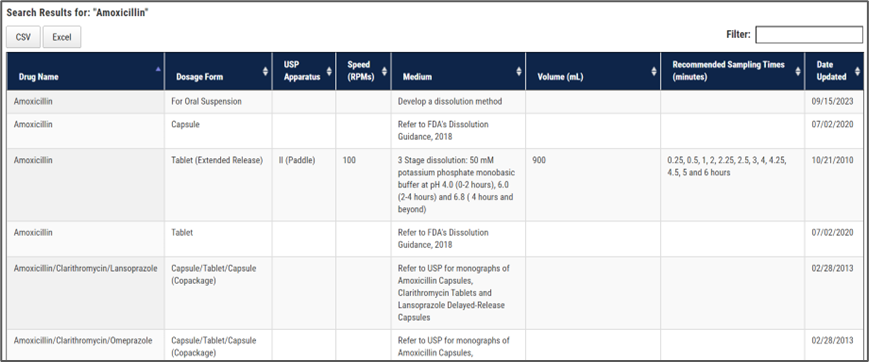
(2) Dissolution Methods Database Search:可查询FDA收录的各种产品的溶出方法;
如上图所示,查询的结果包括装置、转速、介质、介质体积、取样点等信息。
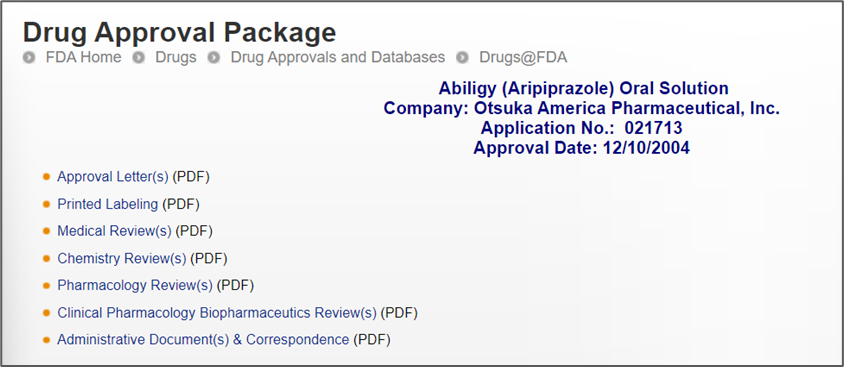
(3) Drugs@FDA Search: 可查询已批准上市药品的信息,包括说明书、审批历史、综述、剂型、规格、理化性质等;可通过药品的英文首字母和批准上市时间来分类查询,查询结果包括药品规格、剂型、给药途径、申报类型(如IND、NDA、ANDA)、批准状态、申请者。
(4) Orange Book:橙皮书,可查询已批准上市化学仿制药的信息,包括专利情况;此外也可查询专利审评状态,为仿制药开发选择参比制剂提供了重要参考。
(5) Product-Specific Guidances for Generic Drug Development Database:可查询特定的仿制药开发指南性文件,查询结果包括原料药的剂型、给药方式、规格、临床试验思路、生物等效性以及指南的状态(终版或草案),为广大药物工作者开发仿制药提供了思路。
(6) Purple Book:紫皮书,收录已批准上市的生物制品信息,生物仿制药和可替代产品及其参比产品,还包括过敏性,细胞和基因疗法,血液和疫苗产品的信息。收录了细胞、血液、基因治疗、疫苗等各类生物制品的数据,也有相关专利信息。
5.1.2 药品开发、申请、审批流程(Development & Approval Process)–注册常用
Drugs选项下的Development & Approval Process模块为注册申报提供了参考:首页详细介绍了药品的开发、申请和审批流程,以及审评要求,并介绍了三种特殊的申请路径——Fast Track(加速审评)、Breakthrough Therapy(突破性疗法)和Priority Review(优先审查),大大缩短了审评时间,有助于加速产品上市。此模块包括以下五项具体内容:
(1) Clinical Data Summary Pilot Program:临床研究试点计划,介绍了CDER开放的临床研究试点计划,并提供了一份研究报告供参考;
(2) Drug Development Tools | DDTs:药品开发工具;
(3) Guidance Documents for Drug Applications:药品申报指南性文件;
(4) Laws, Regulations, Policies and Procedures for Drug Applications:注册申报依据的法律、法规、政策和程序;
(5) Novel Excipient Review Pilot Program:新型辅料审查试点计划,CDER对新型辅料审查的要求,包括初步提案和精选提案两部分。